Материалом для нашего исследования служила ДНК, выделенная из лейкоцитов цельной крови фенольным методом. Район между изучаемыми SNP rs14597164 и rs317925256 имеет длину 37 kb и включает в себя ген MSTN. Для проведения генотипирования нами были разработаны методы, основанные на ПЦР–ПДРФ (полимеразная цепная реакция и полиморфизм длины рестрикционных фрагментов). Подбор праймеров осуществляли в соответствии с первичной структурой ДНК GallusGallus в базе данных NCBI (https://www.ncbi.nlm.nih.gov). Условия ПЦР–ПДРФ приведены в таблице 2. Тест-система по каждому SNP содержала внутренний контроль полноты расщепления фрагмента рестриктазой. Для электрофореза использовали 1,5%-ные агарозные гели, содержащие флуоресцентный краситель бромистый этидий. Электрофорез проводили в течение 1 часа при рабочем напряжении 150 В. 2. Условия проведения ПЦР–ПДРФ при генотипировании rs14597164 и rs317925256
Сигнал флуоресценции фотографировали в системе гель-документации фирмы Kоdаk. Биометрическая обработка данных выполнена с помощью программы Microsoft Excel. Результаты исследования. В результате генотипирования выявили разнообразие генотипов по замене rs14597164 T > G среди опытных популяций генофондных пород. Результаты встречаемости генотипов у анализируемых популяций кур биоресурсной коллекции представлены на рисунке 1. 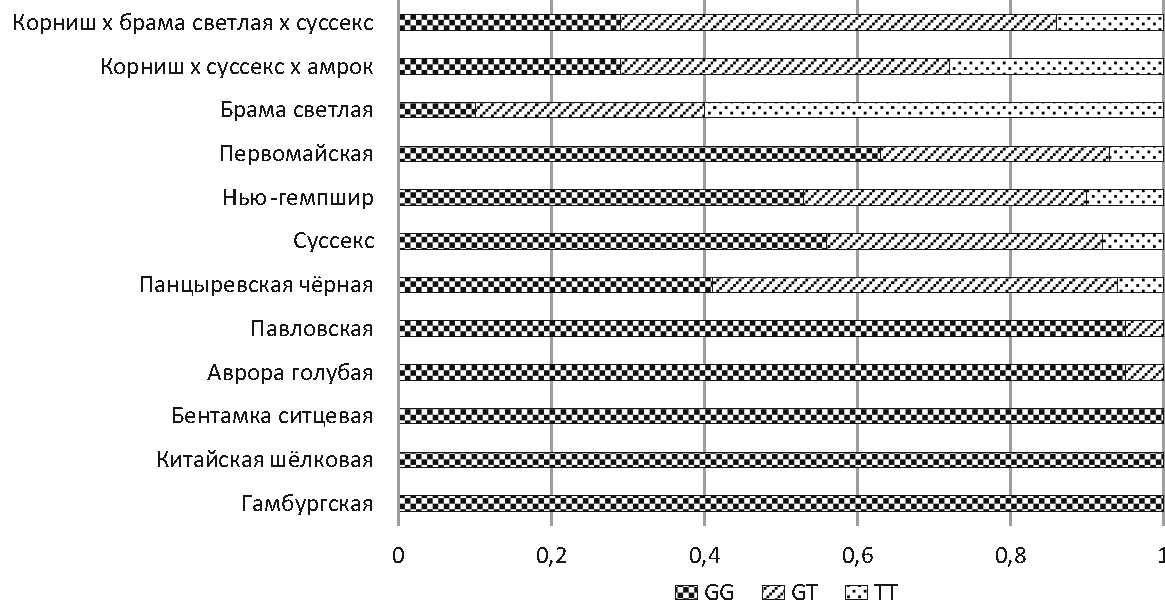
Рис. 1 – Частота встречаемости генотипов по замене rs14597164 T > G среди популяций кур биоресурсной коллекции ВНИИГРЖ Анализ полиморфизма rs14597164 T > G показал, что большая часть популяции кур брама светлая (мясного направления продуктивности) является носителем генотипа TT (0,6), генотип GT встречается с частотой 0,3, а генотип GG является редким и определён только у 10 % выборки кур. В кроссах корниш × суссекс × амрок и корниш × брама светлая × суссекс наблюдается равномерное распределение генотипов за счёт межпородного скрещивания. У пород кур мясо-яичного направления продуктивности, таких, как суссекс, нью-гемпшир, первомайская, наблюдалось значительное преобладание гомозиготного генотипа GG (0,56; 0,53; 0,63), а генотип ТТ определён как редкий, и его частота составила (0,08; 0,1; 0,07) соответственно. У кур яичного направления продуктивности (павловская и аврора голубая) отмечено значительное преобладание генотипа GG (0,95 и 0,95) и аллеля G (0,95). Хотя у кур породы панцыревская чёрная более половины выборки были носителями генотипа GT (0,53), однако также наблюдалось значительное преобладание аллеля G (0,94). Куры декоративных популяций пород гамбургская, китайская шёлковая, бентамка были мономорфны по аллелю G. Анализируя данные по SNP rs317925256, можно отметить, что во всех группах птиц были выявлены все три генотипа, при этом не отмечалось какого-либо сдвига в сторону одного из аллелей (рис. 2). Исключение составила декоративная порода китайская шёлковая, в которой наблюдали преобладание генотипа ТТ, что может быть связано с особенностями выборки. 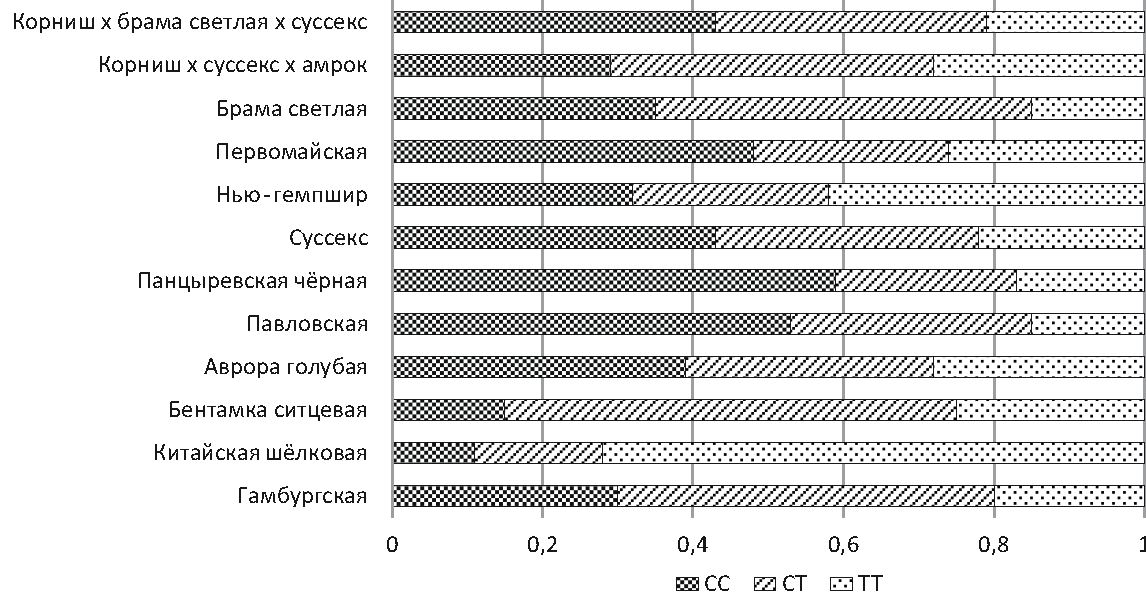
Рис. 2 – Частота встречаемости генотипов по замене rs317925256 T > С среди популяций кур биоресурсной коллекции ВНИИГРЖ В популяциях кур нью-гемпшир (χ 2 = 4,16), первомайская (χ 2 = 5,57) и китайская шелковая (χ 2 = 3,94) наблюдалось смещение генетического равновесия в связи с сильным селекционным давлением. В других анализируемых популяциях биоресурсной коллекции ВНИИГРЖ, независимо от породной принадлежности, значения χ 2 не превышали критического значения (3,84). Таким образом, не наблюдалось достоверной разницы между показателями наблюдаемой и ожидаемой гетерозиготности (табл. 3). 3. Значения χ 2 для популяций кур биоресурсной коллекции ВНИИГРЖ по rs14597164 и rs317925256
Выводы. В нашем исследовании выявлена генетическая изменчивость по SNP rs14597164 T > G в популяциях пород и кроссов различного направления продуктивности. В популяциях кур мясного направления продуктивности преобладающим был генотип ТТ (> 2340,6). У мясо-яичных пород кур преобладали особи с гетерозиготным генотипом TG. Популяции кур яичного и декоративного типа характеризовались высокой частотой встречаемости генотипа GG. По замене rs317925256, не выявлено значимых отличий по частоте встречаемости генотипов среди популяций кур биоресурсной коллекции различного направления продуктивности. Результаты нашего исследования позволяют предположить, что SNP rs14597164 можно рассматривать в качестве ДНК-маркера признака «живая масса» кур. Литература 1. Эффективность использования SNP-маркеров в гене MSTN в селекции кур пушкинской породы / Н.В. Дементьева, А.Б. Вахрамеев, Т.А. Ларкина [и др.] // Вавиловский журнал генетики и селекции. 2019. Т. 23. № 8. С. 993–998. 2. Le Bihan-Duval, E., Berri, C. Genetics and Genomics for Improving Poultry Meat Quality // Poultry Quality Evaluation. 2017. P. 199–220. 3. Kudinov, A. A., Dementieva, N. V., Mitrofanova, O. V., Stanishevskaya, O. I., Fedorova, E. S., Larkina, T. A., Romanov, M. N. Genome-wide association studies targeting the yield of extraembryonic fluid and production traits in Russian White chickens// BMC genomics. 2019. V. 20. No. 1. P. 270. 4. Thomas M., Langley B., Berry C., Sharma M., Kirk S, Bass J., Kambadur R. Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation // J. Biol. Chem. 2000. V. 275. No. 51. P. 40235–40243. 5. Baron A.A., Wenceslau L.E., Alvares K., Nones D.C., Ruy G.S., Schmidt E.L., Zanella L.L., Coutinh M.C., Ledur E.E. High level of polymorphism in the myostatin chicken gene // Proc. 7th World Congr. Genet. Appl. Livest. Prod. Montpellier. 2002. P. 19–23. 6. Связь генотипов по однонуклеотидным заменам в гене миостатина с показателями живой массы у кур Юрловской голосистой породы / О.В. Митрофанова, Н.В. Дементьева, В.И. Тыщенко [и др.] // Генетика и разведение животных. 2015. № 1. С. 39–42. DOI 10.37670/2073-0853-2020-84-4-231-234
_________________ * Исследование выполнено в рамках государственного задания АААА-А18-118021590138-1 с использованием популяций кур из биоресурсной коллекции ЦКП «Генетическая коллекция редких и исчезающих пород кур» (ВНИИГРЖ, Санкт-Петербург, Пушкин).
|
Для авторовСтраничка библиографаВнешний электронный ресурс
СтатистикаПросмотры материалов : 1868265 |
 № 4 (84)
№ 4 (84)








