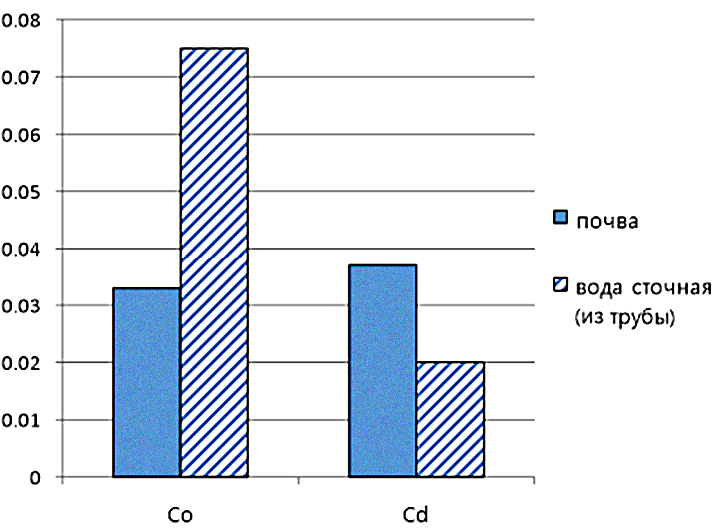
С позиции экологической безопасности мы посчитали необходимым рассчитать коэффициент биологической транслокации кобальта и кадмия в системе почва – растение, что позволило определить эффект биоаккумуляции кобальта в тканях корня и надземных органах Polygonum amphibium (табл. 1, рис. 3). В отношении кадмия нами отмечен физиологический барьер, препятствующий поступлению токсичных элементов в ткани растения, особенно в ассимилирующие и генеративные органы (табл. 1, рис. 3). 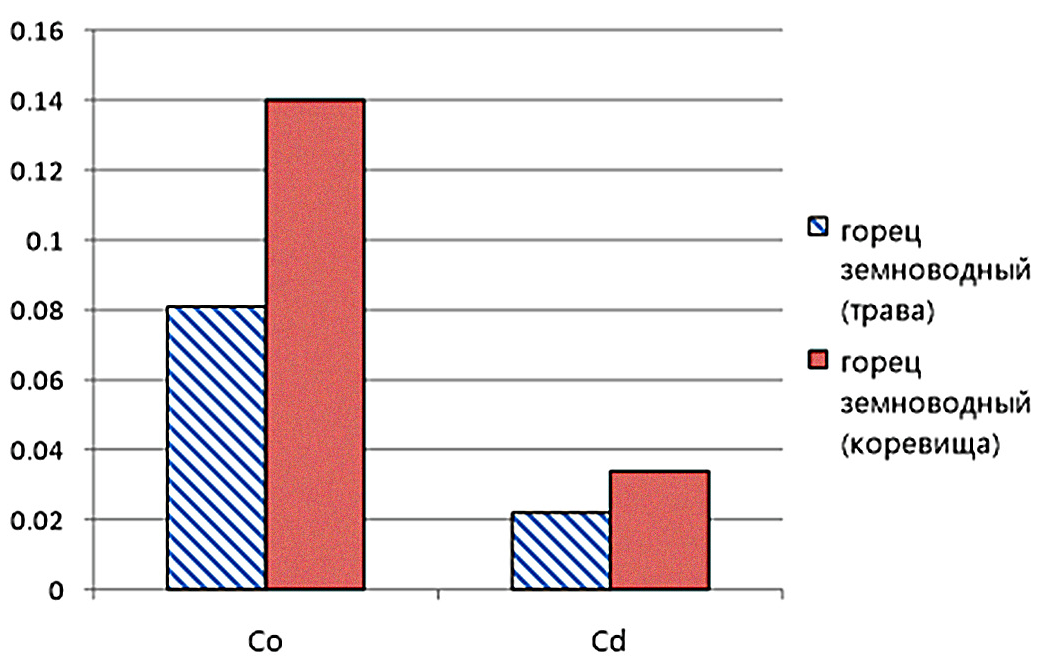
Рис. 2 – Содержание кобальта и кадмия в ЛРС Polygonum amphibium (трава и корневища) на полях орошения ОГПЗ 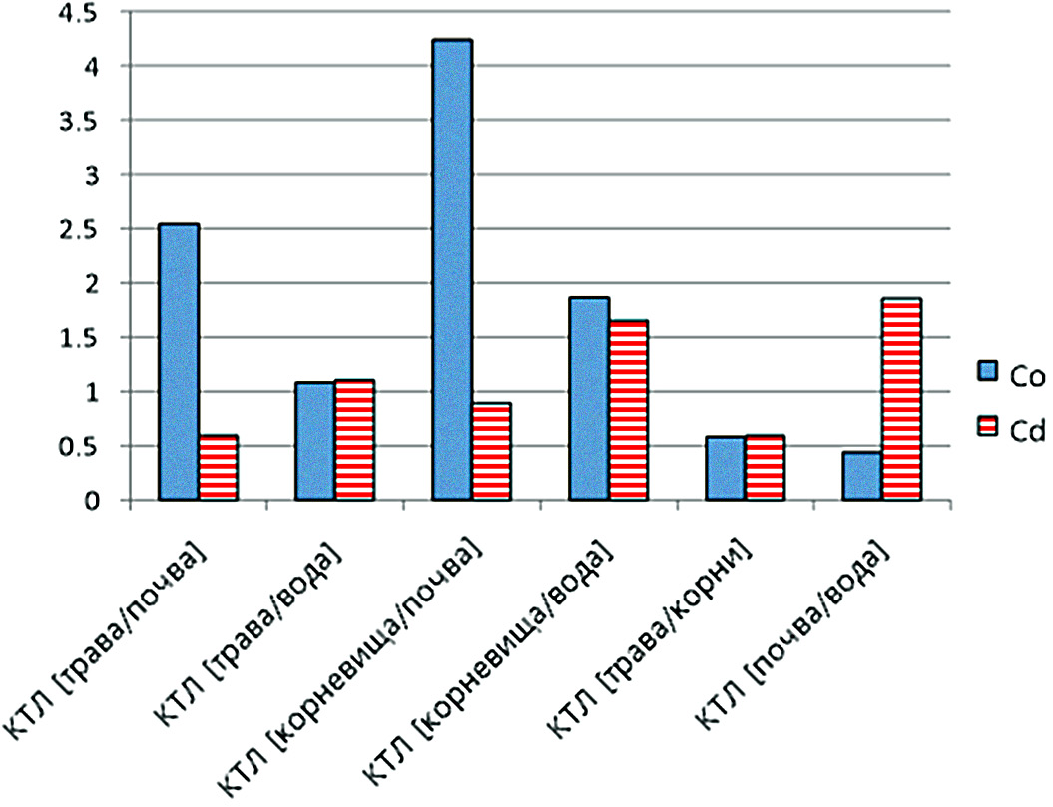
Рис. 3 – Коэффициенты транслокации кобальта и кадмия в различных средах и тканях Polygonum amphibium (трава и корневища) на полях орошения ОГПЗ На биодоступность ТМ для корневой системы растений влияют корневые экссудаты, органические кислоты, сидерофоры и протоны. ТМ поступают в ткани корня преимущественно в форме ионов. Растения могут до известной степени контролировать поглощение и транспорт ТМ, например, с помощью регуляции работы белков-транспортёров, реакциями комплексообразования с последующей секвестрацией, корневой экссудацией органических лигандов. К механизмам адаптации растений к повышенным концентрациям ТМ относятся: хелатирование, компартментация в вакуолях и других клеточных органеллах, а также индукция синтеза антиоксидантов [9]. Хелатирующие вещества растений способствуют детоксикации металла за счёт снижения концентрации свободного металла в цитозоле, что ограничивает его реакционную способность и растворимость. В частности, увеличение биосинтеза хелатирующих соединений (органические кислоты, металлотионеины, фитохелатины, полифенолы, цистеин, глутатион) позволяет накапливать ТМ в тканях корня, защищая тем самым генеративные и ассимилирующие органы от накопления свободных ионов ТМ, которые способны спровоцировать окислительный стресс и гибель клетки [1, 2]. К механизмам токсического действия ТМ относят их способность индуцировать образование активных форм кислорода (АФК). Некоторые ТМ способны оказывать негативный эффект путём вытеснения микро- и макроэлементов, а также нарушая структуры биомолекул и важных стресс-регуляторных белков, хелатируя функциональные группы [10]. Особую озабоченность вызывает кумуляция ТМ при их миграции в пищевых цепях, что связано с риском для здоровья животных и человека [9]. Кобальт относится к важнейшим микроэлементам растений, участвующим в образовании металлоферментов, и максимальное его содержание зафиксировано в хлоропластах и митохондриях растительных клеток. Кобальт положительно влияет на рост высших растений, повышает устойчивость хлорофилла, активизирует ферментные процессы, принимая тем самым участие в окислительном фосфорилировании и фотосинтезе, в матричных синтезах, а также в синтезе кобаламина [1, 6]. Поглощение ионов Cо2+ корнями происходит по механизму пассивного и активного транспорта, но молекулярные механизмы последнего пока не изучены. Скорость поглощения кобальта из почвенного раствора и распределение его в органах и тканях зависят от видовых особенностей растений [10]. Polygonum amphibium, собранный на территории полей орошения ОГПЗ, характеризуется накоплением кобальта в надземных и подземных органах. При этом концентрация данного элемента выше в тканях корня по сравнению с побегами. Содержание Со в сухом веществе растений, согласно литературным данным, составляет от 0,05 до 11,6 мг/кг, что согласуется с полученными нами сведениями (табл. 1). Токсичность повышенных концентраций Со связывают с развитием окислительного стресса, угнетением ассимиляции и трансляционного аппарата, а также развивающимся на фоне избытка кобальта дефицитом железа [11, 12]. При повышенных концентрациях Со в живых организмах отмечается кобальтиндуцируемый апоптоз, блокируемый высокими дозами антиоксидантов. Высокие концентрации Со приводят к нарушениям репарации ДНК в ядре, хлоропластах и митохондриях. Кадмий поступает в почвы в основном с выбросами промышленных предприятий и характеризуется высоким уровнем токсичности и активной миграцией в пищевых цепях, где он способен к кумуляции [1, 11]. Несмотря на то, что Cd не входит в число необходимых для жизнедеятельности растения элементов, он довольно легко поглощается корневой системой и поступает в надземные органы, что подтверждается отмеченным нами отсутствием у Polygonum amphibium физиологического барьера для данного элемента. В малых концентрациях Cd может стимулировать процессы жизнедеятельности растений [11]. Известно, что в основном Cd локализуется в корнях и в меньших количествах – в тканях стебля, черешков и центральных жилок листьев [11]. Токсическое действие кадмия проявляется в снижении интенсивности фотосинтеза и тканевого дыхания, нарушении транспирации, фиксации углекислого газа в листьях и в изменении проницаемости мембран. Благодаря сходству структуры кадмия с цинком он замещает последний в активных центрах многих ферментов, нарушая работу дегидрогеназ, фосфатаз, пептидаз, карбоангидразы [11]. В литературе приводятся данные о косвенном влиянии Cd на образование перекиси водорода, супероксидного и гидроксильного радикалов путём увеличения свободных нехелатированных ионов железа и меди в клетке, принимающих участие в реакции Фентона. Кадмийзащитным эффектом обладают некоторые антиоксиданты: аскорбиновая и салициловая кислоты, токоферол и каротиноиды [12]. Индуцированные кадмием и другими ТМ системы антиоксидантной защиты растений инактивируют активные формы кислорода. Также в загрязнённой среде обитания ТМ индуцируют синтез фитохелатинов, глутатиона и салициловой кислоты в растениях [11, 12]. Наши исследования показали, что Polygonum amphibium способен к установлению физиологического барьера, препятствующего поступлению кадмия в ткани. Наиболее выражен барьер для генеративных и ассимилирующих органов. Данное явление, вероятно, объясняется высоким риском окислительного стресса в отношении ассимилирующих оорганов и опасностью повреждения нуклеиновых кислот – для генеративных. Следует отметить, что повышенные количества ТМ обычно приводят к нарушениям водного обмена, что в нашем случае не является актуальным для растений на полях орошения ОГПЗ. Более того, уже во второй половине июня на фоне окружающей растительности поля орошения выделяются хорошим уровнем продуктивности фитомассы и жизненности растений. Выводы. Проведённый анализ проб почвы и лекарственного растительного сырья Polygonum amphibium позволил установить уровни содержания кобальта и кадмия в исследуемых образцах. Результаты показали, что концентрация кадмия и кобальта в сточной воде и почве не превышает предельно допустимых уровней (ГН 2.1.7.2041 – 06). Почва на полях орошения ОГПЗ в районе исследования отличается выраженным коэффициентом кумуляции для Cd, тогда как накопление кобальта было относительно небольшим. Уровень загрязнения ТМ образцов ЛРС на полях орошения оценивался в сравнении с ГН 2.1.5.1315 – 03. Содержание кадмия и не превышает установленных нормативов. Подземные органы растения харастеризуются более высокими концентрациями кобальта и кадмия, чем надземные органы, что совпадает с литературными данными. Литература 1. Немерешина О.Н., Шайхутдинова А.А. Оценка содержания тяжёлых металлов в тканях Polygonum aviculare L. на техногенно загрязнённых территориях // Экология и промышленность России. 2012. №. 9. С. 46 – 49. 2. Singh U.K., Kumar B. Pathways of heavy metals contamination and associated human health risk in Ajay River basin, India // Chemosphere. 2017. Т. 174. С. 183 – 199. 3. Fageria N. K., Baligar V. C., Jones C. A. Growth and mineral nutrition of field crops. CRC Press, 2010. 4. Yadav S.K. Heavy metals toxicity in plants: an overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants //South African Journal of Botany. 2010. Т. 76. №. 2. С. 167 – 179. 5. Seth C.S., Misra V., Chauhan L.K.S. Accumulation, detoxification, and genotoxicity of heavy metals in indian mustard (Brassica juncea L.) // International journal of phytoremediation. 2012. Т. 14. № 1. С. 1 – 13. 6. Махлаюк В.П. Лекарственные растения в народной медицине. Саратов: Приволжское кн. изд., 1993. 7. Wang L. et al. A review of soil cadmium contamination in China including a health risk assessment //Environmental Science and Pollution Research. 2015. Т. 22. №. 21. С. 16441 – 16452. 8. Cui X. et al. Potential mechanisms of cadmium removal from aqueous solution by Canna indica derived biochar // Science of the Total Environment. 2016. Т. 562. С. 517 – 525. 9. Hu R. et al. Intercropping with hyperaccumulator plants decreases the cadmium accumulation in grape seedlings // Acta Agriculturae Scandinavica, Section B-Soil & Plant Science. 2019. Т. 69. № 4. С. 304 – 310. 10. Benavides M. P., Gallego S. M., Tomaro M. L. Cadmium toxicity in plants // Brazilian journal of plant physiology. 2005. Т. 17. № 1. С. 21 – 34. 11. Sharma V., Naugraiya M. N., Tomar G. S. Toxic effects of cobalt, chromium, lead and nickel chloride on growth performance of siris (Albizia spp.) // IJCS. 2018. Т. 6. № 2. С. 2407 – 2410. DOI 10.37670/2073-0853-2020-83-3-122-126
|
Для авторовСтраничка библиографаВнешний электронный ресурс
СтатистикаПросмотры материалов : 1871600 |
|||||||||||||||||||||||||||||||||||||||
 № 3 (83)
№ 3 (83)